Комментарии рецензента
Данная статья представляет собой всесторонний литературный обзор, посвященный эпитестостерону - природному неактивному эпимеру тестостерона, рассмотренному в контексте его биосинтеза, физиологических функций, метаболизма, современных методов лабораторного определения и прикладного использования в клинической практике и антидопинговом контроле.
Тема статьи актуальна и значима вследствие недостаточной изученности эпитестостерона, его роли в развитии мужского гипогонадизма и потребности в совершенствовании лабораторной диагностики нарушений андрогенного статуса.
- Несмотря на подробный обзор теоретической части и довольно широкий охват темы, не хватает ссылок на оригинальные исследования с достаточной клинической базой и подробными статистическими данными, как российских исследователей, так и зарубежных.
- Рекомендовано улучшить структуру и логическую последовательность некоторых разделов для повышения удобочитаемости и добавить более чёткие формулировки выводов, чтобы акцентировать основные практические рекомендации, ограничения и преимущества метода. Некоторые термины заменить на общепринятые в научно-медицинском мире (антирепродуктивный, антиренотропный?)
- Название статьи и основной вывод не соответствуют друг другу: определение эпитестостерона изолировано или всё-таки в сочетании с другими диагностическими методами (генетическое исследование полиморфизма стероидных генов и стероидогенных ферментных систем)?
- Несмотря на то, что статья посвящена эпитестостерону, она перегружена информацией о тестостероне, которая никак не связана с лабораторной диагностикой эпитестостерона. Автору рекомендуется удалить эту информацию или заменить её исторической справкой об эпитестостероне.
- Автору рекомендуется предоставить ссылки на научные публикации, которые содержат следующие утверждения: «Что касается определения уровня экскреции эпитестостерона с мочой, то в данном случае наиболее информативным и точным методом лабораторной детекции является исключительно только ГХ–МС, которая в российских лабораториях, в отличие от ВЭЖХ–МС, применяется еще реже или вовсе не применяется по причине, опять же, своей большой дороговизны и отсутствия информированности со стороны практикующих врачей».
- «…Анализ методом высокоэффективной газовой хроматографии/изотопной масс-спектрометрии (ВГХ–ИМС), как наиболее точном современном методе определения указанных стероидов.», да, это так, но необходимо предоставить несколько ссылок на оригинальные исследования и мета-анализы.
- Рекомендуется предоставить ссылку на оригинальное исследование с результатами: «В своей клинической работе при обследовании пациентов мы имеем возможность применения современных наиболее точных хроматографических лабораторных методик детекции половых стероидных гормонов и их метаболитов в крови и суточной моче и полагаем, что исследование суточной мочевой экскреции эпитестостерона и расчет отношения Т/Э в суточной моче на основе такого метода, как ГХ–МС, позволяет точнее оценить этиологическую структуру нарушений андрогенного статуса мужчины и решить важнейшие практические вопросы о наличии или отсутствии у него клинически значимого гипогонадизма и, соответственно, показаний для его медикаментозной коррекции в целом ряде сложных клинический ситуаций.» Либо, если это личное мнение автора, его можно указать в заключении, но не в обзоре данных литературы.
- Рекомендуется предоставить ссылку на исследование, где говорится о циркадной зависимости клинических симптомов от уровня тестостерона в разное время суток: «На практике, к сожалению, эти суточные особенности секреции тестостерона сплошь и рядом не учитываются практикующими врачами, и они склонны рассматривать, например, сывороточную концентрацию общего тестостерона в утреннем анализе крови, равную 13 нмоль/л, как «нормальную», не понимая, что в течение дня к вечеру она снизится как минимум на 1/3 от утренней и составит только 9,1 нмоль/л, что рассматривается как «погранично-низкая» концентрация. Очевидно, что с этой точки зрения мужчина с утренней сывороточной концентрацией общего тестостерона в 13 нмоль/л не является, так сказать, «убедительно андрогено-достаточным» в течение всех суток, но чисто математически врач объясняет, что 13 нмоль/л выше, чем 12,1 нмоль/л (нижняя граница референса нормы), и никакую гормональную коррекцию не обсуждает.»
- Это личное мнение автора или научный факт? Если научный факт, то нужна ссылка на научное исследование: «Однако, если по результатам оценки суточной экскреции андрогенов и их метаболитов концентрация тестостерона в суточной моче снижена, а концентрация эпитестостерона повышена, то этот факт может дополнительно указывать на клинически значимый мужской гипогонадизм, особенно убедительно при одновременном сочетании со снижением отношения Т/Э, поскольку свидетельствует о преобладании в сывороточной фракции общего тестостерона у данного пациента неактивного эпимера – эпитестостерона, который в норме в неизменном количестве экскретируется с мочой.»
- Рекомендуется убрать фразу: «И этого анализа ни у кого из мужчин среднего или старшего возраста при обращении к андрологу просто нет! Сравнивать не с чем!», т.к. лучше придерживаться научно-академического языка.
- Мировое научно-медицинское сообщество не проводит эмпирическое лечение «скрытого» гипогонадизма, есть критерии диагноза и они прописаны во всех клинических рекомендациях. Автору рекомендуется предоставить ссылку: «…и повышения качества жизни такого мужчины следует обдумать проведение хотя бы пробной гормональной терапии короткое время (3 месяца), которую нам позволяют проводить все клинические рекомендации, когда врач сомневается в причастности дефицита тестостерона к клинической симптоматике, и по ее результатам ретроспективно решить, есть у пациента клинически значимый андрогенный дефицит или нет».
- Автор предлагает рутинно определять суточную экскрецию эпитестостерона и проводить генетические анализы при нормальных показателях общего и свободного тестостерона, тогда как в мировом научном сообществе более полувека назад пришли к общему мнению, что данный метаболит не подходит для диагностики гипогонадных состояний: «Однако, как и в первом случае, многие вопросы можно было бы решить быстрее и эффективнее при использовании результатов оценки суточной экскреции андрогенов и их метаболитов методом ГХ–МС и параллельных генетических исследований.»?
- Рекомендуется подкрепить ссылками на научные исследования утверждение: «Если в суточной моче концентрация тестостерона существенно снижена, концентрация эпитестостерона существенно повышена, а отношение Т/Э низкое, этот факт может, по нашему мнению, объяснять факт наличия клинического мужского гипогонадизма у мужчины с сывороточным общим тестостероном в диапазоне 18–25 номль/л преобладанием во фракции общего тестостерона неактивного эпимера – эпитестостерона, и при отсутствии другой доступной медицинской информации о ранее выявляемых сывороточных уровнях общего тестостерона может стать предметом обсуждения возможной гормональной коррекции, особенно при сочетании с функционально пассивным типом андрогенового рецептора по результатам генетических исследований его полиморфизма».
- Рекомендуется предоставить ссылку на исследование или не включать личный опыт без подкрепления опубликованными данными: «Согласно нашим предварительным данным, у этой категории гипогонадных мужчин также выявляется существенное повышение суточной мочевой экскреции эпитестостерона при пониженной (реже) и даже нормальной (чаще) мочевой суточной экскреции тестостерона на фоне снижения отношения Т/Э.»
- Рекомендуется сослаться на научные источники: «Выявленные лабораторные находки у этих пациентов позволяют, очевидно, рассматривать высокий индивидуальный уровень синтеза в организме и секреции с мочой эпитестостерона, который, возможно, для своей транспортировки также требует присутствия ГСПС, поэтому уровень этого главного транспортного белка-переносчика андрогенов в сыворотке крови растет. Данное утверждение, безусловно, является только рабочей гипотезой, поскольку статистической обработки полученных лабораторных данных мы не проводили, а литературных источников, подтверждающих его, не обнаружили.»
- Необходимо определить тип научной публикации. Если это научный обзор, то он должен состоять из научных ссылок, подкрепляющих гипотезу авторов, если это оригинальное исследование, подкрепленное результатами личных наблюдений, то возможны личные размышления авторов: «Завершая этот раздел нашего обзора литературы, отметим, что все наши вышеописанные размышления о потенциальной роли эпитестостерона в оптимизации диагностики и гормональной терапии мужского гипогонадизма, основанные на собственных клинических наблюдениях, представляют собой пока несистематизированный и статистически не обработанный пул получаемых лабораторных данных, отражающий, возможно, лишь некоторые лабораторно-клинические тенденции, а потому претендующий пока на роль исключительно рабочей гипотезы, которую надо или подтверждать, или опровергать в ходе дальнейших крупномасштабных клинических исследований.»
- Личные гипотезы, умозаключения и подозрения уместны в разделе «Заключение».
- При рекомендации к применению предложенного алгоритма диагностики коллегам этот метод должен быть валидирован клиническими исследованиями: «Кроме того, обладая собственным практическим опытом использования хроматографических/масс-спектрометрических методов лабораторной диагностики нарушений обмена андрогенов в крови и моче, а также генетических исследований полиморфизмов генов стероидных рецепторов и стероидогенных ферментных систем биотрасформации половых стероидных гормонов, мы полагаем, что такая комплексная оценка андрогенного статуса позволяет в целом ряде случаев существенно оптимизировать пациент-ориентированный (персонализированный) подход к диагностике и выбору метода гормональной коррекции нарушений обмена андрогенов у мужчин, прежде всего, мужского гипогонадизма.»
Таким образом, хотя предложение может показаться обоснованным, оно противоречит существующему консенсусу и научным данным. Для подтверждения предлагаемого метода необходимы дополнительные исследования и доказательства его эффективности и надежности.
В целом статья представляет собой подробный литературный обзор, который будет полезен как для исследователей, так и для клиницистов, интересующихся современными аспектами диагностики и терапии нарушений андрогенного обмена, и может быть рекомендована к публикации после учёта вышеуказанных замечаний.
Прикладное значение лабораторной детекции эпитестостерона для оптимизации диагностики и терапии нарушений обмена андрогенов у мужчин
(обзор литературы)
Е.А.Греков1, И.А.Тюзиков2
1Клиника «Hormone Life», Москва
2Медицинский центр «Тандем–Плюс», Ярославль
Адрес для переписки: Греков Евгений Александрович, gea84@bk.ru
Абстракт
Литературный обзор посвящен одной из наименее изученных природных форм тестостерона – эпитестостерону, который является неактивным андрогенным эпимером тестостерона (веществом с абсолютно аналогичными молекулярной массой и атомным составом) и неотъемлемой фракцией общего тестостерона сыворотки крови у мужчин. На основе доступных литературных данных в обзоре рассматриваются основные изученные аспекты клинической эндокринологии эпитестостерона, такие, как его биосинтез, метаболизм, распределение в организме и экскреция из организма. Отдельно представлены имеющиеся в литературе данные о потенциальных физиологических эффектах эпитестостерона, установленных преимущественно в экспериментальных исследованиях и заключающихся в слабом конкурентном связывании с андрогенными рецепторами и ингибировании биотрансформации тестостерона в более активный метаболит 5α–дигидротестостерон (5α–ДГТ) за счет блокады стероидогенных ферментов семейства 5α–редуктаз (антиандрогенный эффект), ингибировании секреции гонадотропинов в гипофизе (антигонадотропный эффект), а также регуляции массы почек (антиренотропный эффект) и ингибировании функций клеток Сертоли яичек (антирепродуктивный эффект). Большое внимание уделено рассмотрению современных методологических проблем, связанных с определением концентрации эпитестостерона в биологических жидкостях (кровь, моча), и показано, что только применение высоко эффективных хроматографических методик в сочетании с масс-спектрометрией позволяет получить наиболее точные и достоверные результаты лабораторной детекции данного гормона.
Установление в проведенных ранее исследованиях факта независимости мочевой концентрации эпитестостерона от внешнего введения тестостерона стало основой для разработки и реализации современного допинг-контроля злоупотребления экзогенными препаратами тестостерона и анаболическими андрогенными стероидами в спорте на основе расчета отношения концентраций тестостерона и эпитестостерона (отношение Т/Э) в моче, отражающего емкость ферментных систем, способных трансформировать экзогенный тестостерон в неактивные метаболиты. Кроме того, на основе собственного клинического опыта рассматривается потенциальное прикладное значение лабораторного определения эпитестостерона с точки зрения оптимизации диагностических и лечебных подходов при мужском гипогонадизме.
Ключевые слова: эпитестостерон, тестостерон, высокоэффективная хроматография–тандемная масс-спектрометрия, отношение «тестостерон/эпитестостерон» (Т/Э), допинг-контроль, мужской гипогонадизм
The applied value of epitestosterone laboratory detection for optimizing the diagnosis and therapy of androgen metabolism disorders in men (literature review)
E.A. Grekov1, I.A. Tyuzikov2
1 Clinic «Hormone Life», Moscow
2Medical Center «Tandem–Plus», Yaroslavl
Contact: Evgeniy A. Grekov, gea84@bk.ru
Abstract
The literature review is devoted to one of the least studied natural forms of testosterone, epitestosterone, which is an inactive androgen epimer of testosterone (a substance with absolutely similar molecular weight and atomic composition) and an integral fraction of total serum testosterone in men. Based on the available literature data, the review examines the main studied aspects of clinical endocrinology of epitestosterone, such as its biosynthesis, metabolism, distribution in the body and excretion from the body. The data available in the literature on the potential physiological effects of epitestosterone are established mainly in experimental studies and presented separately, consisting in weak competitive binding to androgen receptors and inhibition of biotransformation of testosterone into the more active metabolite 5α–dihydrotestosterone (5α–DHT) due to blockade of steroidogenic enzymes of the 5α–reductase family (antiandrogenic effect), inhibition of gonadotropin secretion in the pituitary gland (antigonadotropic effect), as well as regulation of kidney mass (antirenotropic effect) and inhibition of testicular Sertoli cell functions (anti-reproductive effect). Much attention has been paid to the consideration of modern methodological problems related to the determination of epitestosterone concentration in biological fluids (blood, urine), and it has been shown that only the use of highly effective chromatographic techniques in combination with mass spectrometry makes it possible to obtain the most accurate and reliable results of laboratory detection of this hormone. The establishment in previous studies of the independence of urinary epitestosterone concentration from external testosterone administration became the basis for the development and implementation of modern doping control of the abuse of exogenous testosterone preparations and anabolic androgenic steroids in sports based on the calculation of the ratio of testosterone and epitestosterone concentrations (T/E ratio) in urine, reflecting the capacity of enzyme systems capable of transforming exogenous testosterone into inactive metabolites. In addition, based on our own clinical experience, we consider the potential practical significance of laboratory determination of epitestosterone in terms of optimizing diagnostic and therapeutic approaches for male hypogonadism.
Keywords: epitestosterone, testosterone, high–performance chromatography–tandem mass spectrometry, testosterone/epitestosterone ratio (T/E), doping control, male hypogonadism
Введение
Эффекты тестостерона у мужчин изучались на протяжении всей истории человечества. Первые научные эксперименты по трансплантации яичек провел в 1767 году Д. Хантер, который стал основоположником научной эндокринологии и хирургии. В 1846 году А.А. Бертольд впервые в науке связал физиологические и поведенческие изменения, связанные с кастрацией, с веществом, выделяемым яичками. В 1989 году француз Ч.Э. Браун-Секард положил начало органотерапии в 1889 году, когда объявил, что его самоинъекция экстрактов из яичек привела к восстановлению физических и умственных способностей. Краеугольным камнем современной андрогенной терапии стало то, что А.И. Бутенандт в 1931 году впервые выделил стероидные андрогены из мочи, а Э. Лакер в 1935 году впервые получил 10 мг тестостерона в кристаллической форме, переработав 100 кг ткани семенников, и именно Э. Лакер закрепил название «тестостерон» за полученным им веществом. В 1935 году А.И. Бутенандт и Г. Ханиш описали химический синтез тестостерона, который был реализован в промышленном масштабе в 1939 году, и в этом же году А.И. Бутенандт получил Нобелевскую премию по химии, которую он разделил с Л.С. Ружичкой, расшифровавшим молекулярную структуру тестостерона [1].
Препараты тестостерона стали популярны благодаря своим биологическим свойствам, и в конце 1940-х — начале 1950-х годов тестостерон и его производные использовались чаще всего для лечения состояний, связанных с дефицитом тестостерона, и для увеличения мышечной массы. В 1950-х и 1960-х годах фармацевтическая промышленность стала больше интересоваться новыми андрогенами и метаболитами тестостерона, чем самим тестостероном, и сосредоточила свои исследования андрогенов на химической модификации стероидных молекул, чтобы отделить различные эффекты тестостерона и производить преимущественно эритропоэтические или анаболические стероиды. В 1956 году в учебниках по андрогенам уже было описано 256 андрогенных стероидов, а к 1976 году их число увеличилось до более чем 1000 молекул [2].
В настоящее время тестостерон и его основные метаболиты (5α–дигидротестостерон (5α–ДГТ) и эстрогены) являются одними из наиболее изученных половых стероидных гормонов у мужчин, чего нельзя сказать о других биологических формах тестостерона, в частности, эпитестостероне – природном эпимере тестостерона, о котором впервые сообщили L.C. Clark и Ch.D. Kochakian в 1947 году [3]. Впоследствии в течение 1970–1990-х годов было проведено большое количество клинико-экспериментальных исследований, позволивших в определенной степени приоткрыть завесу тайны над механизмами биосинтеза, метаболизма, экскреции и потенциальными биологическими эффектами эпитестостерона, однако, несмотря на это, полного и всеобъемлющего ответа на вопрос о его истинном происхождении, физиологической роли и, самое главное, прикладном значении его лабораторного определения в биологических жидкостях организма человека в рамках исследования андрогенного статуса до сих пор нет [4].
Эпитестостерон: биосинтез и распределение в организме
Эпитестостерон, или изотестостерон (или 17α–тестостостерон, или 17 –гидрокси–4–андростен–3–он) – это природный неактивный эпимер тестостерона (вещество с абсолютно аналогичными молекулярной массой и атомным составом), который отличается от последнего исключительно только особенностями пространственной изомерии окси-содержащего атома углерода в положении –С17 [5](Рис. 1.).
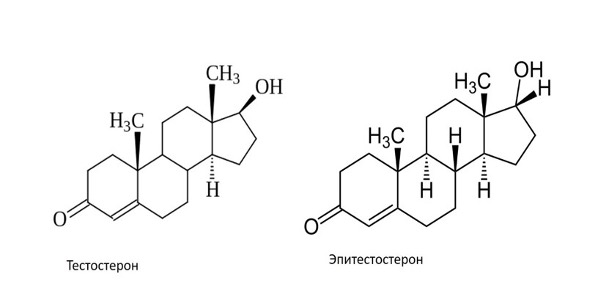
Рис.1. Химическая структура тестостерона и эпитестостерона [5]
Как уже было сказано ранее, впервые об эпитестостероне сообщили L.C. Clark и Ch.D. Kochakian в 1947 году при исследовании срезов печени кролика [3], а в дальнейшем было установлено, что он является обычным компонентом стероидного состава плазмы крови и мочи у млекопитающих и человека, а также играет роль природного фитостерина, содержащегося, например, в пыльце сосны (Pinus silvestris L.) [6].
У некоторых млекопитающих (кролик, морская свинка, мышь), имеющих высокую активность 17α–гидроксистероидоксидоредуктазы, значительная доля эпитестостерона образуется в результате простой биотрансформации тестостерона в андростендион и далее в эпитестостерон, при этом данный процесс зависит не только от вида животного, но и характеризуется определенной органотропностью: например, у мышей удельный вес эпитестостерона, образованного в почках, в которых в качестве ко-фактора функционирует никотинамид-динуклеотид-фосфат (НАДФ), достигает 70%, в то время, как в мышиной печени данный андроген не синтезируется [7]. Также показано, что эпитестостерон образуется из тестостерона и андростендиона in vitro в печени и почках кролика, печени собаки, яичниках кобылы, крови быка и овцы, а также в печени, почках, яичниках и семенниках, но не в надпочечниках морских свинок [8].
У человека биосинтез эпитестостерона до сих пор изучен недостаточно, а доступные литературные данные крайне противоречивые. По мнению одних исследователей, если взаимопревращение тестостерона и эпитестостерона у человека и происходит, то оно выражено крайне незначительно, если вообще имеет место, а сам эпитестостерон отражает метаболизм преимущественно эндогенного тестостерона [8]. Другие авторы показали, что, по меньшей мере, половина суточной выработки эпитестостерона у мужчин приходится на клетки Лейдига яичек, а вклад надпочечников в выработку эпитестостерона у мужчин относительно невелик [9]. В частности, показано, что базальная скорость выведения глюкуронида эпитестостерона у здоровых мужчин (62–751 нмоль/24 ч) была значительно выше, чем у мужчин с гипогонадизмом (3–34 нмоль/24 ч), а средний базальный уровень в сыворотке крови выше (1,32 ± 0,08 нмоль/л), чем у гипогонадных мужчин (0,68 ± 0,04 нмоль/л) [9]. В каждой группе стимуляция синтетическим адренокортикотропным гормоном (АКТГ) повышала уровень кортизола в плазме крови в 4 раза. У здоровых мужчин в ответ на стимуляцию АКТГ уровень кортизола в плазме и моче не изменялся, а уровень глюкуронида в плазме и моче снижался. У гипогонадных мужчин уровень эпитестостерона после стимуляции АКТГ повышался в плазме крови и моче, в то время как уровень тестостерона в плазме крови оставался неизменным. Авторы сделали заключение, что именно яички являются основным источником эпитестостерона, при этом вклад надпочечников относительно невелик. После стимуляции надпочечников с применением АКТГ уровень глюкуронида эпитестостерона в моче значительно повышается у мужчин с гипогонадизмом, но у нормогонадных мужчин это увеличение замаскировано, поскольку тестикулярная продукция, вероятно, подавляется повышением уровня кортизола, вызванным АКТГ [9].
По данным Dehennin L. (1993), изучившего концентрации эпитестостерона и тестостерона, их свободных и сульфоконъюгированных форм, а также 5-андростен-3β,17α–диола и его 17β–эпимера самым точным методом высокоэффективной газовой хроматографии/масс-спектрометрии с разведением стабильными изотопами в плазме крови периферических и семенных вен у мужчин с варикоцеле слева, все эти андрогены секретируются яичками, о чем свидетельствуют значительные градиенты концентрации между периферической кровью и кровью из семенной вены [10]. Половина суточной выработки эпитестостерона приходится на яички, в то время как 95% сульфата тестостерона и примерно 70% сульфата эпитестостерона также имеют тестикулярное происхождение, а выявленные достоверные корреляции между эпитестостероном и 5-андростен-3β,17α–диолом являются признаком того, что 5–ене–путь также участвует в биосинтезе эпитестостерона [10].
Существует также мнение, что у человека эпитестостерон в яичках, возможно, может синтезироваться из прегненолона, определенная часть которого превращается в 5-андростен-3β,17α–диол и далее под влиянием 3β-гидроксистероиддегидрогеназы/Δ4,5-изомеразы в эпитестостерон, таким образом, избегая стадию промежуточного образования дегидроэпиандростерона (ДГЭА) и андростендиона, характерных для надпочечникового стероидогенеза [11].
Первые литературные данные о концентрациях эпитестостерона в плазме крови и моче у человека, определенные радиоиммунными методами, были опубликованы Bılek R. et al. (1987), по данным которых средний уровень эпитестостерона в плазме крови здоровых мужчин составил 0,44 ±0,15 нмоль/л и у здоровых женщин– 0,092±0,056 нмоль/л, а соответствующие концентрации в моче составили 320±70 нмоль/л (мужчины) и 273±100 нмоль /л (женщины), соответственно [12]. Несколько позже результаты измерений уровня эпитестостерона в крови у мужчин в зависимости от возраста с помощью радиоиммунного анализа провели Lapcık O. et al. (1995), которые выявили четкую возрастную зависимость концентрации эпитестостерона в плазме крови у мужчин в возрасте 6–65 лет, а именно: у мальчиков до наступления половой зрелости эпитестостерон преобладает над тестостероном, а соотношение эпитестостерон/тестостерон в крови в детском возрасте является наиболее высоким. У взрослых мужчин в дальнейшем тестостерон начинает преобладать, а соотношение эпитестостерон/тестостерон в крови резко снижается с возрастом [13].
В дальнейшем H. Havlıková et al. (2002) при изучении уровней эпитестостерона в крови не только у мужчин, но и у женщин в возрастном аспекте установили, что концентрации эпитестостерона в плазме крови зависят от возраста и составляет в среднем 2,5 нмоль/л у взрослых мужчин и 1,2 нмоль/л у взрослых женщин [14].
Эти же авторы показали, что кривые возрастной зависимости уровней данного гормона различались у мужчин и у женщин [14]. Для эпитестостерона у взрослых мужчин была получена возрастная кривая концентрации с максимумом в возрасте около 35 лет (при этом уровни циркулирующего эпитестостерона оказались в 5–10 раз ниже, чем циркулирующего тестостерона), после чего наблюдалось постепенное и постоянное снижение концентрации в крови [14]. У женщин максимум эпитестостерона в крови был обнаружен примерно на 15 лет раньше (в возрасте 20 лет), за которым следует непрерывное снижение вплоть до менопаузы, а затем выраженный рост концентрации в постменопаузе [14]. Как у мужчин, так и у женщин выраженное снижение соотношения эпитестостерон/тестостерон в период полового созревания и в подростковом возрасте заканчивалось после наступления половой зрелости на значениях 0,1–0,2 у мужчин и 0,7–0,8 у женщин [14] (Рис. 2.).
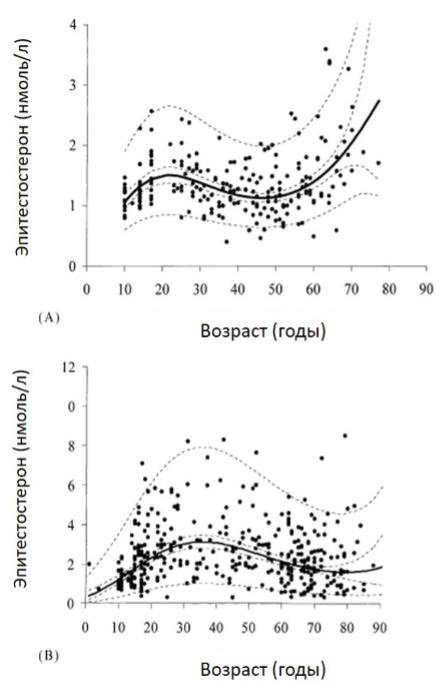
Рис. 2. Возрастные зависимости концентрации эпитестостерона в сыворотке крови 211 женщин в возрасте 10–77 лет (А) и 386 мужчин в возрасте 1–91 года (Б) [14]
По данным Starka L. (2003), существует почти постоянное соотношение уровней эндогенного тестостерона к уровням эндогенного эпитестостерона (отношение Т/Э) в моче у взрослых здоровых мужчин, которое в среднем колеблется от 1,1:0,5 до 1,1:2,5 (диапазон колебаний значений 0,03–4,9) [4].
Эпитестостерон также был обнаружен у мужчин в гиперплазированной предстательной железе, где его концентрация сопоставима с концентрацией андростендиона и примерно в 2 раза превышает концентрацию тестостерона и 5α–ДГТ [15], а в ткани предстательной железы пациентов, получавших финастерид в течение 8 недель, наблюдалось значительное снижение не только содержания 5α–ДГТ, но и андростендиона и эпитестостерона, тогда как концентрация тестостерона значительно возрастала [16]. У женщин эпитестостерон в высоких концентрациях обнаружен в фолликулярной жидкости из преовуляторных фолликулов у женщин при стимулированных циклах [17] и в содержимом кист молочной железы [18].
Эпитестостерон: потенциальные физиологические функции
Эпитестостерон представляется неотъемлемой, но физиологически не активной фракцией общего тестостерона сыворотки крови, но, поскольку андрогенная активность у данного соединения отсутствует, либо не поддается детектированию, то синтетические препараты эпитестостерона не разработаны и, соответственно, не используются в клинической практике [4, 8].
В 1987 году B.A. Nuck и A.W. Lucky впервые в эксперименте показали, что эпитестостерон, вводимый подкожно, предотвращает андрогенную стимуляцию полового органа золотистого сирийского хомячка, выражающуюся в пигментации, росте сальных желез и диаметре волосяных фолликулов, и эта активность в отношении конкурентного ингибирования активности 5α–редуктазы и, соответственно, ингибирования синтеза 5α–ДГТ рассматривалась как основной механизм антиандрогенной активности эпитестостерона [19].
Антиандрогенные эффекты эпитестостерона доказаны в ранних экспериментальных исследованиях. В частности, в экспериментах он уменьшал эффекты тестостерона пропионата на прирост массы тела, снижал массу семенных пузырьков и почек у кастрированных самцов мышей, т.е., демонстрировал значительную антиандрогенную и антиренотропную активность [20]. При этом эффект эпитестостерона был более выраженным, чем антиандрогенное действие ципротерона ацетата [21] на фоне его несколько более высокого относительного сродства к клеткам предстательной железы по сравнению с ципротерона ацетатом [22].
В более поздних экспериментальных исследованиях установлено, что у кастрированных самцов крыс линии Wistar введение эпитестостерона приводило к уменьшению общей массы тела, массы яичек, снижению секреции Антимюллерова гормона (АМГ) и увеличению экспрессии конексина (белка щелевых контактов) в яичках [23].
Кроме антиандрогенной активности, у эпитестостерона в экспериментах была подтверждена его антигонадотропная активность [4, 21]. В частности, у самцов мышей введение эпитестостерона снижало секрецию лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ) в гипофизе [21]. У самок же антигонадотропная активность эпитестостерона демонстрировала интересный двухфазный эффект, более выраженный в отношении секреции ЛГ, чем ФСГ, возможно, за счет различного дозозависимого воздействия на уровни гипоталамуса и гипофиза [24].
Таким образом, эпитестостерон, не обладая собственной биологической активностью, является слабым конкурентным антагонистом андрогеновых рецепторов и достаточно мощным ингибитором 5α–редуктазы (то есть антиандрогеном) и дополнительно проявляет антигонадотропную активность, что теоретически может вносить дополнительный вклад в гормональную регуляцию андроген-зависимых функций, например, контроль роста предстательной железы и половых органов, распределение волос на теле или рост волос на волосистой части головы [25, 26].
Эпитестостерон также ингибирует 17α-гидроксилирование и С19-20-десмолазу в семенниках крыс и тестикулярной ткани человека, однако биологическое значение данного механизма до сих пор остается неизвестным [27].
В ряде исследований у эпитестостерона также выявлен эффект, сходный с неклассическим эффектом тестостерона, который состоит в регуляции деполяризации мембранного потенциала клеток Сертоли за счет обеспечения быстрого поступления в них ионов Ca2+ [28]. В экспериментальных моделях химической кастрации с использованием антагониста гонадотропин-рилизинг гормона (ГнРГ) цетрореликса у самцов крыс, которые в дальнейшем получали в течение 7 дней эпитестостерон или тестостерон, показано, что иммунореактивность андрогенных рецепторов в клетках Сертоли яичек после введения эпитестостерона оставалась сниженной, а дополнительное назначение тестостерона не приводило к ее восстановлению. Однако, и эпитестостерон, и тестостерон приводили к нормализации аногенитального расстояния и массы яичек, которые были снижены в результате экспериментальной химической кастрации [28].
Аногенитальное расстояние – это расстояние между анусом и корнем мошонки, определяемое штангенциркулем, которое, как полагают некоторые исследователи, является результатом фетального воздействия половых стероидов, предсказывает при рождении аногенитальное расстояние у взрослых мужчин и поэтому может рассматриваться как своеобразный маркер оценки функции яичек и андрогенного статуса [29, 30]. В частности, при обследовании 116 мужчин (средний возраст 36,1 ± 8,0 лет) было установлено, что аногенитальное расстояние было достоверно (r = 0,20, p = 0,03) связано с уровнем тестостерона в сыворотке крови, в то время как общий размер яичек с ним не был связан (r = 0,17, p = 0,07). После поправки на возраст уровень тестостерона в сыворотке крови повышался на 20,1 нг/дл (95% ДИ 1,8–38,4; р = 0,03) на каждый 1 см увеличения аногенитального расстояния. У мужчин с гипогонадным уровнем тестостерона (<300 нг/дл) аногенитальное расстояние было значительно меньше, чем у мужчин с более высоким уровнем тестостерона (31,6 против 37,3 мм, соответственно; р = 0,02) [30].
Ранее упомянутый эффект усиленного поступления ионов Са2+ (деполяризация) в клетки Сертоли под влиянием эпитестостерона не подавляется антиандрогеном флутамидом, что позволяет предположить, что эффекты эпитестостерона на клетки Сертоли осуществляются независимо от внутриклеточных андрогенных рецепторов [31]. Однако, деполяризующий эффект эпитестостерона подавлялся верапамилом (блокатором кальциевых каналов), и препаратом U-73122 (ингибитором фосфолипазы С), что указывало на то, что эпитестостерон воздействует на потенциал мембран клеток Сертоли посредством неклассического сигнального пути, аналогичному действию тестостерона на мембрану клеток Сертоли в интактных семенных канальцах яичек самцов крыс [31, 32]. Кроме того, у мужчин была обнаружена достоверная сильная отрицательная корреляция между уровнями эпитестостерона и эстрадиола в сыворотке крови [33], но ингибирования ароматазы при этом не наблюдалось [34].
Эпитестостерон: метаболизм и экскреция
Метаболизм эпитестостерона, как и его биосинтез у человека изучен недостаточно, но исследования, проведенные в 1990–2000-х годах, показали, что эпитестостерон плохо или практически не метаболизируется в организме человека в измеримых количествах ни в 16-андростен-3-ол, ни в тестостерон [4, 8]. В человеческом организме только эпитестостерон плаценты может быть ароматизирован до 17α–эстрадиола [35]. В 1964 году эпитестостерон впервые был выделен из человеческой мочи [36]. Показано, что у взрослых мужчин уровень синтеза эпитестостерона составляет всего 3% от уровня синтеза тестостерона, но уровень его суточной экскреции составляет около 33 % от уровня суточной экскреции тестостерона [8].
В частности, у здоровых мужчин, которым вводят меченый эпитестостерон, примерно 50% введенной радиоактивности с мочой выводилось в виде неизмененного эпитестостерона, тогда как 5β– и 5α–андростан-3α,17α-диолы составляли около 5%, а фракция «этиохоланолон + андростерон» – только 2% [8]. Экскреция эпитестостерона у человека происходит с мочой в основном в виде глюкуронида или сульфата [37, 38], при этом общая экскреция эпитестостерона с мочой несколько ниже, чем у тестостерона, и составляет 200–500 нмоль/сутки у мужчин и 80–500 нмоль/сутки у женщин [12].
При исследовании суточной мочевой экскреции эпитестостерона у детей препубертатного возраста одни авторы не выявили ни достоверной разницы между мальчиками и девочками, ни какой-либо очевидной связи с возрастом [4], однако, по данным других авторов, она повышается у мальчиков после полового созревания и достигает максимума между 20 и 30 годами и позже и, в отличие от небольшого снижения уровня тестостерона, остается почти постоянным до шестого десятилетия жизни, а далее снижается почти до препубертатного уровня [39].
У здоровых женщин наибольшая экскреция эпитестостерона наблюдалась на 22–23–й дни менструального цикла, а у многих женщин с гирсутизмом, хотя экскреция эпитестостерона с мочой и повышена, однако, концентрация эпитестостерона в моче, в отличие от концентрации тестостерона, не коррелирует с вирилизацией пациенток [37]. У мужчин с гипогонадизмом экскреция эпитестостерона с мочой оказалась ниже нормы, но повышалась вместе с экскрецией тестостерона при введении хорионического гонадотропина человека (ХГЧ) [4,8].
Некоторые авторы сообщают о возможном наличии у эпитестостерона ритмов суточной экскреции с мочой [40]. В частности, Walton M.J. et al. (2007) показали, что у здоровых мужчин суточная экскреция тестостерона с мочой не имеет характерных для сыворотки крови циркадных колебаний уровней, однако, как у здоровых мужчин, так и мужчин c медикаментозным подавлением секреции гонадотропинов (препарат тестостерона + этоногестрел) суточная экскреция эпитестостерона имела характерный утренний пик, несмотря на заметно более низкую экскрецию у здоровых мужчин [40]. У мужчин с доброкачественной гиперплазией предстательной железы в возрасте 61–70 лет выявлена субнормальная экскреция эпитестостерона с мочой (24,5±12,8 мкг/сутки) по сравнению с аналогичными по возрасту здоровыми мужчинами (42,8±14,3 мкг/сутки) [4].
Эпитестостерон: методологические поблемы лабораторной диагностики
Для определения уровней эпитестостерона в крови и моче человека исторически использовались различные лабораторные методики: флуориметрические, электрохимические, радиоиммунологические, хроматографические [4]. Однако, большинство исследователей пишут о том, что определение уровня эпитестостерона в биологических жидкостях весьма затруднено в связи с тем, что широко используемые в настоящее время в клинической практике устаревшие радиоиммунологические методы (иммуноферментный анализ (ИФА) и радиоиммунный анализ (РИА)) принципиально не подходят даже для корректного определения уровней любых стероидных гормонов, включая андрогены, и их стероидных метаболитов в рутинной лабораторной диагностике в андрологии и эндокринологии, а эпитестостерон в сыворотке крови данными методами вообще практически не детектируется [41–43].
Адекватно и достоверно провести лабораторную диагностику нарушений обмена андрогенов и их метаболитов, включая эпитестостерон, в биологических жидкостях (кровь, моча) сегодня можно только с использованием доступных в клинической практике хроматографических методов лабораторной диагностики: высокоэффективной жидкостной хроматографии (ВЭЖХ), высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией (ВЭЖХ-МС), газовой хроматографии в сочетании с тандемной масс-спектрометрией (ГХ-МС), а также более сложных методов молекулярно-импринтированного плазмонного резонанса (резонансном возбуждении плазмонов (псевдочастиц, представляющих собой кванты колебаний электронного газа), под влиянием электромагнитной волны в тонком слое проводящего материала, помещенного между двух сред с разными показателями преломления) и методов клонирования регуляторных генов, применяющихся пока только в научно-исследовательских целях [41–43].
Кроме того, существуют также методики определения эпитестостерона в образцах волос, в основе которых лежат те же принципы газовой хроматографии в сочетании с тандемной масс-спектрометрией (ГХ-МС) [44].
Хроматографические лабораторные методы в настоящее время во всем мире являются общепризнанным «золотым стандартом» точного определения сывороточных уровней любых стероидных гормонов, включая андрогены. В нашей стране эти методики также являются доступными в рутинной клинической практике, однако, реальная частота их использования для диагностики нарушений обмена андрогенов находится на критически низком уровне, что связано, по нашему мнению, прежде всего, с неосведомленностью подавляющего большинства врачей, занимающихся вопросами мужской эндокринологии, об этих наиболее высокоточных методах лабораторной детекции стероидных гормонов, включая андрогены, а также, к сожалению, с их достаточно высокой стоимостью.
Кроме того, более широкому практическому применению хроматографических методов лабораторной диагностики нарушений обмена андрогенов в определенной степени способствует отсутствие во всех современных клинических гайдлайнах мировых, континентальных и российских научных сообществ, регламентирующих ведение мужчин с гипогонадизмом, рекомендаций по использованию в лабораторной диагностике данной патологии хроматографических методов, что опять же, вероятно, упирается в сравнительно высокую стоимость данных методик лабораторной диагностики, оплата которой не может быть компенсирована средствами из государственного бюджета, а ложится на плечи пациентов, большинство из которых, чего греха таить, далеко не всегда готовы тратить большие средства на свою диагностику, что опять же отражает экономическую сторону проблемы и замыкает своеобразный «порочный диагностический круг», когда неадекватная диагностика существенно снижает частоту и объективность выявления истинных патогенетических механизмов заболевания, что впоследствии не позволяет осуществить соответствующее патогенетическое лечение, затягивая сроки выздоровления или вообще делая его невозможным.
Что касается определения уровня экскреции эпитестостерона с мочой, то в данном случае наиболее информативным и точным методом лабораторной детекции является исключительно только ГХ–МС, которая в российских лабораториях, в отличие от ВЭЖХ–МС, применяется еще реже или вовсе не применяется по причине, опять же, своей большой дороговизны и отсутствия информированности со стороны практикующих врачей.
Справедливости ради, следует отметить, что интерес к определению в суточной моче метаболитов тестостерона и эпитестостерона с целью диагностики мужского гипогонадизма в широких врачебных кругах действительно за последние десятилетия практически снизился до нуля. Это связано с тем, что результаты единичных исследований по данной проблеме до сих пор не позволили не только установить точные референсные значения «нормального» мочевого уровня эпитестостерона у здоровых мужчин, но, тем более, выявить хоть какие-нибудь достоверные корреляционные связи между мочевыми уровнями эпитестостерона и сывороточными уровнями эпитестостерона и общего тестостерона [4].
В этой связи в настоящее время, пожалуй, единственным диагностическим применением хроматографических методов определения суточной экскреции тестостерона и эпитестостерона является спортивная медицина, поскольку в ходе ранее проведенных исследований было установлено почти постоянное соотношение уровней эндогенного тестостерона к уровням эндогенного эпитестостерона (отношение Т/Э) в моче у взрослых здоровых мужчин, что послужило методологической основой для разработки и широкого внедрения методов контроля за допингом тестостероном и различными андрогенными анаболическими стероидами (ААС) в спорте [4, 21].
Эпитестостерон: современное диагностическое значение в антидопинговом контроле
Теоретическая база методов допинг-контроля основана на концепции, что у человека обычно эндогенный тестостерон и эпитестостерон вырабатываются в равных количествах, а эндогенный тестостерон не может быть преобразован в значительное количество эпитестостерона в связи с низкой видовой активностью соответствующего стероидогенного фермента трансформации 17α–гидроксистероиддегидрогеназы [45].
Соответственно, дополнительное использование экзогенного тестостерона (например, ААС) увеличивает относительное количество тестостерона по сравнению с эпитестостероном. Чтобы преодолеть трудности с установлением строгих ограничений на допустимые концентрации экзогенного тестостерона, а также дополнительно исключить случаи выявления ложноположительных результатов у лиц с высоким уровнем эндогенного тестостерона, было предложено определять соотношение концентраций тестостерона и его неактивного эпимера эпитестостерона (Т/Э) в моче. Иными словами отношение Т/Э отражает емкость ферментных систем, способных трансформировать эндогенный и экзогенный тестостерон в неактивные метаболиты [46].
Поэтому у спортсменов, злоупотребляющих экзогенным тестостероном и/или другими ААС, наблюдается повышение отношения Т/Э в моче: например, при попадании в человеческий организм экзогенного тестостерона, андростендиона или дегидроэпиандростерона (ДГЭА) концентрация тестостерона в моче возрастает, в то время как концентрация эпитестостерона падает или изменяется незначительно, что в итоге приводит к увеличению отношения Т/Э [47].
В первых тестах на Панамериканских играх 1983 года в качестве критерия положительного результата теста использовалось отношение T/Э, равное 6:1 [48]. Однако, в 2005 году Всемирное антидопинговое агентство (WADA) снизило верхний предел допустимого отношения T/Э до 4:1, а Международный олимпийский комитет (МОК) утвердил это соотношение для своих аккредитованных лабораторий в качестве произвольного критического значения в качестве единственного теста на незаконное самостоятельное введение препаратов экзогенного тестостерона [49]. Следует особо сказать, что в 2011 году эпитестостерон Всемирным антидопинговым агентством (WADA) также был включен в список маскирующих применение препаратов экзогенного тестостерона и/или ААС и потому запрещенных веществ к применению в спорте [49].
Результаты тестирования действительны только при условии, что клиренс обоих эпимеров одинаков и что тестостерон, вводимый экзогенно, на самом деле не метаболизируется в эпитестостерон, и что соотношение обоих эпимеров не зависит от расовых или индивидуальных различий. В этой связи были введены некоторые исключения для лиц с очень низкой экскрецией эпитестостерона (например, для гипогонадных мужчин), а также расово-этнические различия (например, для японцев отношение T/Э в норме составляет 1,99, для айнов – 2,77, а для африканцев оно может превышать 6) [50].
Выявлено, что азиатские подгруппы населения выделяют тестостерон с мочой на более низком уровне, чем европеоиды, что приводит к относительно низкому отношению T/Э [51]. Также известно, что выявление злоупотребления ААС у представителей азиатского населения с помощью стероидного модуля биологического паспорта спортсмена является сложной задачей из-за высокой распространённости у них полиморфизма гена UGT2B17 и низкого уровня глюкуронида тестостерона [52]. При использовании ХГЧ одновременно со стимулированным тестостероном повышается мочевая экскреция и эпитестостерона, в результате отношение Т/Э практически не изменяется [53, 54].
На значения отношения Т/Э также влияет потребление различных внешних веществ, например, алкоголя, причем в большей степени этот феномен наблюдается у женщин, чем у мужчин [55]. Применение некоторых флавоноидов (метоксиизофлавона или иприфлавона) вызывает изменение отношения Т/Э в моче в пределах 55–80% от исходных значений [56], в то время, как нестероидные противовоспалительные средства (НПВС) не оказывают существенного влияния на выведение с мочой глюкуронидов тестостерона и эпитестостерона [57]. Однократное системное введение глюкокортикостероидов снижает соотношения «Андростерон/Тестостерон» и «5α-адиол/Эпитестостерон» в моче, а длительный прием глюкокортикостероидов приводит к зависящему от длительности приема снижению скорости выведения некоторых метаболитов с мочой (5α-адиола, андростерона и этиохонанолона), однако, на показатели отношения T/Э это существенно не влияет [58].
В 2014 году Всемирное допинговое агентство (WADA) ввела во всех аккредитованных лабораториях обязательное количественное определение 6 эндогенных стероидов (тестостерон, эпитестостерон, андростерон, этиохоланолон, 5α-андростан-3α,17β-диол и 5β-андростан-3α,17β-диол), набор которых получил название «стероидный профиль», данные которого на каждого спортсмена хранятся в системе управления результатами (ADAMS) [59]. Если значение одного или нескольких параметров стероидного профиля не соответствует ранее полученным (например, отношение Т/Э >4), система автоматически отправляет запрос в лабораторию на подтверждающий анализ методом высокоэффективной газовой хроматографии/изотопной масс-спектрометрии (ВГХ–ИМС), как наиболее точном современном методе определения указанных стероидов. Если концентрация эпитестостерона в образце мочи по результатам данного метода превышает пороговое значение в 200 нг/мл, пробу оценивают как «положительная» [60].
Эпитестостерон: потенциальное значение для оптимизации диагностики и фармакотерапии мужского гипогонадизма
Главный вопрос, который обязательно зададут скептики при прочтении данного раздела обзора – зачем нам нужно детально изучать эпитестостерон, если уже установлено, что он, обладая определенными антиандрогенными и антигонадотропными физиологическими эффектами, хоть и является постоянным компонентом фракции общего тестостерона сыворотки крови, но представляет собой неактивный эпимер тестостерона, который по этой причине вообще не используется в медицине в качестве лекарственного гормонального препарата? В добавок ко всему, вся современная стандартная лабораторная диагностика мужского гипогонадима связана исключительно с сывороточной детекцией общего тестостерона, глобулина, связывающего половые стероиды (ГСПС) и последующим расчетом уровня свободного тестостерона и не требует проведения никаких диагностических манипуляций с эпитестостероном [61, 62]. Однако, мы полагаем, что именно по этим причинам, несмотря на доказанное присутствие эпитестостерона в биологических жидкостях как постоянной, пусть и не активной фракции общего тестостерона, этот факт сегодня продолжает игнорироваться исследователями и клиницистами, по аналогии с тем, как, например, долгие десятилетия с момента открытия в 1940-х годах игнорировалась или недооценивалась роль надпочечниковых андрогенов (в частности, дегидроэпиандростерона (ДГЭА)) в мужском гормональном статусе, пока в XXI веке не появились новые современные методы их точной лабораторной индикации в крови (ВХ–МСМ), которые снова возродили научно-практический интерес к данной группе андрогенов.
В своей клинической работе при обследовании пациентов мы имеем возможность применения современных наиболее точных хроматографических лабораторных методик детекции половых стероидных гормонов и их метаболитов в крови и суточной моче и полагаем, что исследование суточной мочевой экскреции эпитестостерона и расчет отношения Т/Э в суточной моче на основе такого метода, как ГХ–МС, позволяет точнее оценить этиологическую структуру нарушений андрогенного статуса мужчины и решить важнейшие практические вопросы о наличии или отсутствии у него клинически значимого гипогонадизма и, соответственно, показаний для его медикаментозной коррекции в целом ряде сложных клинический ситуаций.
Например, хорошо известно, что с учетом суточных (циркадных) ритмов секреции тестостерона, утренняя концентрация общего тестостерона в крови должна отражать пик (максимум) секреции гормона в течение суток, а в вечернее время у большинства мужчин уровень общего тестостерона крови оказывается сниженным на 10–50% (в среднем 30%) по отношению к утреннему значению сывороточных концентраций. Это и есть нормальная эндокринология тестостерона, которая сводится к следующему: чем больше тестостерона секретируется в кровь утром, тем больше будет его депо в крови и тем на дольше хватит его для обеспечения всех тестостерон-зависимых функций мужчины в течение суток [63, 64].
На практике, к сожалению, эти суточные особенности секреции тестостерона сплошь и рядом не учитываются практикующими врачами, и они склонны рассматривать, например, сывороточную концентрацию общего тестостерона в утреннем анализе крови, равную 13 нмоль/л, как «нормальную», не понимая, что в течение дня к вечеру она снизится как минимум на 1/3 от утренней и составит только 9,1 нмоль/л, что рассматривается как «погранично-низкая» концентрация. Очевидно, что с этой точки зрения мужчина с утренней сывороточной концентрацией общего тестостерона в 13 нмоль/л не является, так сказать, «убедительно андрогено-достаточным» в течение всех суток, но чисто математически врач объясняет, что 13 нмоль/л выше, чем 12,1 нмоль/л (нижняя граница референса нормы), и никакую гормональную коррекцию не обсуждает. Конечно, скажут скептики, есть мужчины с функционально активными андрогеновыми рецепторами (количество эволюционно консервативных повторов триплета CAG (цитозин–аденин–гуанин) в первом экзоне гена андрогенового рецептора <18), которые выявляются при генетических исследованиях полиморфизма гена андрогенового рецептора) [65]. Таким мужчинам не надо много тестостерона для взаимодействия с рецепторами и обеспечения внутриклеточных эффектов гормона. Да, есть такие мужчины, но разве исследование полиморфизма гена андрогенового рецептора мы проводим одновременно с определением общего тестостерона в крови? Нет, не проводим, потому что данное генетическое обследование во всех клинических рекомендациях по мужскому гипогонадизму вообще не упоминается, а врач может не иметь ни малейшего представления о возможностях, простоте и высокой диагностической роли подобных современных генетических исследований. Итог визита к врачу – мужчина из группы потенциального риска индивидуального гипогонадизма признается здоровым и не получает никакой коррекции.
Однако, если по результатам оценки суточной экскреции андрогенов и их метаболитов концентрация тестостерона в суточной моче снижена, а концентрация эпитестостерона повышена, то этот факт может дополнительно указывать на клинически значимый мужской гипогонадизм, особенно убедительно при одновременном сочетании со снижением отношения Т/Э, поскольку свидетельствует о преобладании в сывороточной фракции общего тестостерона у данного пациента неактивного эпимера – эпитестостерона, который в норме в неизменном количестве экскретируется с мочой. Если же у данного пациента вдобавок при генетическом исследовании выявляется функционально пассивный андрогеновый рецептор (количество эволюционно консервативных повторов триплета CAG (цитозин–аденин–гуанин) в первом экзоне гена андрогенового рецептора >26) [65], то клинически значимый (абсолютный) гипогонадизм, требующий обязательной гормональной коррекции (тестостерон-заместительная терапия (ТЗТ) (препараты экзогенного тестостерона) или тестостерон-стимулирующая терапия (препараты хорионического гонадотропина человека, или ХГЧ)) получает свое еще большее подтверждение. При функционально активном типе андрогенового рецептора (количество CAG-повторов в гене андрогенового рецептора <18) медикаментозная коррекция андрогенного статуса может не понадобиться, а при функционально нормальном типе рецептора (количество CAG-повторов в гене андрогенового рецептора 20–26) [65], возможно, будет иметь место индивидуальный (латентный) дефицит тестостерона, для дифференциальной диагностики которого может понадобиться пробная ТЗТ или терапия ХГЧ в течение 3 месяцев в зависимости от репродуктивных ожиданий пациента.
С другой стороны, если по результатами оценки мочевых уровней тестостерона, эпитестостерона и отношения Т/Э полученные данные свидетельствуют о преобладании тестостерона над эпитестостероном, то, очевидно, это факт может объяснять те клинические случаи, когда даже сывороточный общий тестостерон в пределах нижней терцили диапазона нормальных референсных значений (12–18 нмоль/л) с учетом известных суточных ритмов и тенденцией к снижению в вечернее время не сопровождается наличием клинических симптомов дефицита тестостерона, поскольку доля неактивного эпимера (эпитестостерона) в структуре фракции общего тестостерона у этих мужчин мала, а доля активных биодоступных форм тестостерона, соответственно, высока. И здесь опять важные одновременные генетические исследования полиморфизма гена андрогенового рецептора: если он нормальный или активный – то, скорее всего, никакого гормонального лечения не надо, если же он пассивный – то, скорее всего, гормональная коррекция все же необходима.
Второй частый пример. Мужчина среднего возраста с сывороточным уровнем общего тестостерона в средней терцили диапазона нормальных референсных значений (18–25 нмоль/л), предъявляющий диагностически значимые жалобы, весьма подозрительные на наличие у него дефицита тестостерона по шкале AMS, является потенциальным кандидатом для назначения тестостерон-заместительной или тестостерон-стимулирующей терапии? С высокой долей вероятности, большинство врачей не станет его дальше обследовать, скажет, что с тестостероном у него все хорошо, но надо искать другие причины его жалоб и пошлет по кругу к различным специалистам. Вроде логично, но, а вдруг у него настолько пассивные андрогеновые рецепторы, что и этого «нормального» запаса в крови тестостерона ему не хватает для полноценной жизни? Неизвестно, мы же рутинно все подряд не проводим исследования генетики андрогенового рецептора. Но даже и без генетики закономерно возникает вопрос, а какой уровень общего тестостерона в крови был у него, скажем, в 20-25 лет на пике гормона? Вдруг это был молодой человек с сильной половой конституцией и сывороточным уровнем общего тестостерона в пределах 30-40 нмоль/л? На этот вопрос нам не ответит на один мужчина, потому что нет у нас в стране привычки (а тем более официальных медицинских рекомендаций) определять всем молодым людям свой тестостерона в 20–25 лет, когда и так все зависимые от него функции работают как надо. Но мы забываем, что цифра сывороточного уровня тестостерона в возрасте 20–25 лет знаменует собой максимальный уровень гормона в крови у мужчины, а впереди, хоть и долгая жизнь, но такая же долгая возрастная постепенная с 30 лет потеря тестостерона, которая на каком-то этапе жизни станет настолько критической, что появятся клинические симптомы, и возникнет необходимость сравнить имеющийся результат измерения в крови уровня тестостерона и тем, который был в молодости. И этого анализа ни у кого из мужчин среднего или старшего возраста при обращении к андрологу просто нет! Сравнивать не с чем!
Конечно, если все-таки какая-то динамическая лабораторная оценка уровня общего тестостерона у пациента в течение нескольких последних лет имеется, и она свидетельствует о прогрессирующем снижении уровня гормона, то очевиден индивидуальный андрогенный дефицит, и для ликвидации клинических симптомов (прежде всего, их, потому что правильная модель коррекции дефицита тестостерона состоит не в учете результатов анализов, а в учете клинической картины и ее динамики (так называемая пациент-ориентированная модель)) и повышения качества жизни такого мужчины следует обдумать проведение хотя бы пробной гормональной терапии короткое время (3 месяца), которую нам позволяют проводить все клинические рекомендации, когда врач сомневается в причастности дефицита тестостерона к клинической симптоматике, и по ее результатам ретроспективно решить, есть у пациента клинически значимый андрогенный дефицит или нет. Однако, как и в первом случае, многие вопросы можно было бы решить быстрее и эффективнее при использовании результатов оценки суточной экскреции андрогенов и их метаболитов методом ГХ–МС и параллельных генетических исследований. Если в суточной моче концентрация тестостерона существенно снижена, концентрация эпитестостерона существенно повышена, а отношение Т/Э низкое, этот факт может, по нашему мнению, объяснять факт наличия клинического мужского гипогонадизма у мужчины с сывороточным общим тестостероном в диапазоне 18–25 номль/л преобладанием во фракции общего тестостерона неактивного эпимера – эпитестостерона, и при отсутствии другой доступной медицинской информации о ранее выявляемых сывороточных уровнях общего тестостерона может стать предметом обсуждения возможной гормональной коррекции, особенно при сочетании с функционально пассивным типом андрогенового рецептора по результатам генетических исследований его полиморфизма.
Наконец, исследования суточной экскреции эпитестостерона позволяют объяснить случаи повышения сывороточных уровней ГСПС, не объяснимых другими известными факторами [63,64], у молодых мужчин и мужчин среднего возраста с сывороточным уровнем общего тестостерона в пределах референсных значений нормы (12–33 нмоль/л), но имеющих при этом клинические симптомы гипогонадизма. Согласно нашим предварительным данным, у этой категории гипогонадных мужчин также выявляется существенное повышение суточной мочевой экскреции эпитестостерона при пониженной (реже) и даже нормальной (чаще) мочевой суточной экскреции тестостерона на фоне снижения отношения Т/Э. Выявленные лабораторные находки у этих пациентов позволяют, очевидно, рассматривать высокий индивидуальный уровень синтеза в организме и секреции с мочой эпитестостерона, который, возможно, для своей транспортировки также требует присутствия ГСПС, поэтому уровень этого главного транспортного белка-переносчика андрогенов в сыворотке крови растет. Данное утверждение, безусловно, является только рабочей гипотезой, поскольку статистической обработки полученных лабораторных данных мы не проводили, а литературных источников, подтверждающих его, не обнаружили. С другой стороны, если наша гипотеза логична, то с определенной долей вероятности высоким индивидуальным уровнем эпитестостерона в сыворотке крови можно будет объяснять не только существенное и необъяснимое другими известными факторами сывороточных концентраций ГСПС у молодых мужчин и мужчин среднего возраста с сывороточным уровнем общего тестостерона в пределах референсных значений нормы (12–33 нмоль/л), но и ранее также ничем не объяснимое наличие у них клиники дефицита тестостерона, степень выраженности которой, как представляется, будет во многом зависеть от полиморфизма гена андрогенового рецептора у них.
Таким образом, у врача, серьезно занимающегося вопросами диагностики и коррекции нарушений обмена тестостерона, всегда есть масса практических вопросов и тактических проблем, решать которые не позволяют даже современные гайдлайны. Это объясняется тем, что все мужчины с гипогонадизмом разные, а все возможные индивидуальные особенности обмена андрогенов, безусловно, не поддаются единой универсальной систематизации. И вот этих сложных клинических случаях огромную диагностическую ценность может иметь определение стероидного профиля суточной мочи на основе методики ГХ–МС в сочетании с результатами генетических исследований показателей андрогенного обмена, которые, по нашему мнению, позволят оптимизировать пациент-ориентированный и персонализированный характер диагностики и лечения мужского гипогонадизма.
Завершая этот раздел нашего обзора литературы, отметим, что все наши вышеописанные размышления о потенциальной роли эпитестостерона в оптимизации диагностики и гормональной терапии мужского гипогонадизма, основанные на собственных клинических наблюдениях, представляют собой пока несистематизированный и статистически не обработанный пул получаемых лабораторных данных, отражающий, возможно, лишь некоторые лабораторно-клинические тенденции, а потому претендующий пока на роль исключительно рабочей гипотезы, которую надо или подтверждать, или опровергать в ходе дальнейших крупномасштабных клинических исследований.
Заключение
Однако, с разработкой, внедрением и всё большей доступностью в последние десятилетия новых высокоточных хроматографических/масс-спектрометрических лабораторных методов определения половых стероидных гормонов в клинической практике появилась уникальная возможность более детального и всестороннего изучения этого неактивного андрогенного эпимера тестостерона, обладающего, как показано в экспериментах, определенными антиандрогенными эффектами, потенциально способными влиять на общий андрогенный статус мужчины и гормональную регуляцию его андроген-зависимых функций организма. Именно хроматографические/масс-спектрометрические методы лабораторной диагностики позволили уточнить диагностическое значение определения суточной мочевой экскреции эпитестостерона, которая стала фундаментальной методологической основой для разработки и внедрения современных высокоточных методов допинг-контроля в спорте и спортивной медицине. Кроме того, обладая собственным практическим опытом использования хроматографических/масс-спектрометрических методов лабораторной диагностики нарушений обмена андрогенов в крови и моче, а также генетических исследований полиморфизмов генов стероидных рецепторов и стероидогенных ферментных систем биотрасформации половых стероидных гормонов, мы полагаем, что такая комплексная оценка андрогенного статуса позволяет в целом ряде случаев существенно оптимизировать пациент-ориентированный (персонализированный) подход к диагностике и выбору метода гормональной коррекции нарушений обмена андрогенов у мужчин, прежде всего, мужского гипогонадизма. В связи с практически полным отсутствием в доступной нам современной литературе данных подобной направленности, мы убеждены, что для подтверждения или опровержения нашей точки зрения (рабочей гипотезы) крайне важно проводить доказательные клинические исследования по всесторонней оценке прикладного (практического) значения лабораторной детекции эпитестостерона у мужчин в целом и у гипогонадных мужчин, в частности.
Литература
- Freeman E.R., Bloom D.A., McGuire E.J. A brief history of testosterone. J Urol. 2001;2(165): 371–373.
- Nieschlag E., Nieschlag S. Testosterone deficiency a historical perspective. Asian J Androl. 2014; 16(2):161–168.
- Clark L.C., Kochakian Ch.D. The in vitro metabolism of testosterone to _4-androstenedione-3,17, cis-testosterone and other steroids by rabbit liver slices. J Biol Chem. 1947;170: 23–33.
- Stárka L. Epitestosterone. J Steroid Biochem Mol Biol. 2003; 87(1):27–34.
- Beastall G.H. Clinical Biochemistry of Steroid Hormones: Methods and Applications. First Edition. Elsevier Science Publishing Company.1983, 320 р.
- Šaden-Krehula M., Tajic M., Kolbah D. Testosterone, epitestosterone and androstenedione in the pollen of Scotch pine P. silvestris L. Naturwiss. 1971; 27:108–109.
- Arimasa N., Kochakian Ch.D. Epitestosterone and 5_-androstane-3_,17_-diol: the characteristic metabolites of androst-4-ene-3,17-dione produced by mouse kidney in vitro. Endocrinol. 1973; 92(1):72–82.
- Wilson H., Lipsett M.B. Metabolism of epitestosterone in man. J Clin Endocrinol Metab. 1966; 26: 902–914.
- Kicman A.T., Coutts S.B., Cowan D.A., et al. C. Adrenal and gonadal contributions to urinary excretion and plasma concentration of epitestosterone in men—effect of adrenal stimulation and implications for detection of testosterone abuse. Clin Endocrinol. 1999; 50: 661–668.
- Dehennin L. Secretion by the human testis of epitestosterone, with its sulfoconjugate and precursor androgen 5-androstene-3 beta,17 α-diol. J Steroid Biochem Mol Biol. 1993; 44 (2): 171–177.
- Weusten J.J, Legemaat G., van der Wouw M.P., et al. The mechanism of the synthesis of 16-androstenes in human testicular homogenates. J Steroid Biochem. 1989; 32:689–694.
- Bılek R., Hampl R., Putz Z., et al. Radioimmunoassay of epitestosterone: methodology. J Steroid Biochem. 1987; 28: 723–729.
- Lapcık O., Hampl R., Hill M., et al. Plasma levels of epitestosterone from prepuberty to adult life. J Steroid Biochem Mol Biol. 1995; 55: 405–408.
- Havlıková H., Hill M., Stárka L. Sex- and age-related changes in epitestosterone in relation to pregnenolone sulfate and testosterone in normal subjects. J Clin Endocrinol Metab. 2002; 87: 2225–2231.
- Stárka L., Hampl R., Hill M. et al. Epitestosterone in human blood and prostatic tissue. Eur J Clin Chem Clin Biochem. 1997;35: 469–473.
- Hill M., Petrık R., Hampl R., et al. The concentrations of the endogenous C19-steroids in hyperplastic prostatic tissue and the effect of finasteride treatment. Horm Metab Res. 1996; 28: 562–564.
- Dehenin L., Scholler R. Androgen and 19-norsteroid profiles in human preovulatory follicules from stimulated cycles: an isotope dilution-mass spectrometric study. J Steroid Biochem. 1987;26: 399–405.
- Biciková M., Szamel I., Hill M. et al. Allopregnanolone, pregnenolone sulfate, and epitestosterone in breast cyst fluid. Steroids. 2001; 66: 55–57.
- Nuck B.A., Lucky A.W. Epitestosterone: a potential new antiandrogen. Invest Dermatol. 1987; 89:209–221.
- Stárka L., Broulik P.D., Hampl R. et al. Antirenotropic action of antiandrogens cyproterone acetate, casodex, flutamide and epitestosterone. Endocrinol Regul. 1996; 30: 93–97.
- Stárka L., Hampl R., Bicıková M. et al. Observations on the biological activity of epitestosterone. Physiol Rev. 1991;40: 317–326.
- Monsalve A., Blaquier J.A. Partial characterization of epididymal 5-reductase in the rat. Steroids. 1977; 30: 41–51.
- da Rosa L.A., Escott G.M., Simonetti R.B., et al. Role of non-classical effects of testosterone and epitestosterone on AMH balance and testicular development parameters. Mol Cell Endocrinol. 2020;511: 110850.
- Bicıková M., Kanceva R., Lapcık O., et al. The effect of epitestosterone on the plasma levels of LH and FSH in ovarectomized rat. J Steroid Biochem Mol Biol. 1993; 44: 321–324.
- Stárka L., Bicíková M., Hampl R. Epitestosterone – an endogenous antiandrogen? J Steroid Biochem. 1989; 33 (5): 1019–1021.
- Schiffer L., Arlt W., Storbeck K.H. 5alpha-reduction of epitestosterone is catalysed by human SRD5A1 and SRD5A2 and increases androgen receptor transactivation. J Steroid Biochem Mol Biol. 2024; 241:106516.
- Bicıková M., Hampl R., Stárka L. Epitestosterone—a potent competitive inhibitor of C21 steroid side chain cleavage in the testes. J Steroid Biochem Mol Biol. 1992; 43: 721–724.
- Cavalari F.C., da Rosa L.A., Escott G.M., et al. Epitestosterone- and testosterone-replacement in immature castrated rats changes main testicular developmental characteristics. Mol Cell Endocrinol. 2017; 461:112–121.
- Marín-Martínez F.M., Arense-Gonzalo J.J., Artes M.A., et al. Anogenital distance and the risk of Late-onset hypogonadism. Urol. 2025;92(1):134–140.
- Eisenberg M.L., Jensen T.K., Walters R.C., et al. The relationship between anogenital distance and reproductive hormone levels in adult men. J Urol. 2012;187(2): 594–598.
- de Castro A.L., Cavalari F.C., Diello M.V., et al. Epitestosterone and testosterone have similar nonclassical actions on membrane of Sertoli cells in whole seminiferous tubules. Horm Metab Res. 2013; 45(1):15–21.
- da Rosa L.A., Escott G.M., Cavalari F.C., et al. Non-classical effects of androgens on testes from neonatal rats. Steroids. 2015; 93: 32–38.
- Hill M., Bılek R., Šafarık L., et al. Analysis of relations between serum levels of epitestosterone, estradiol, IGF-1 and prostatic specific antigen in men with benign prostatic hyperplasia and carcinoma of the prostate. Physiol Res. 2000; 49 (Suppl. 1): S113–118.
- Bicıková M., Klak J., Hill M., et al. The effect of epitestosterone on estrogen biosynthesis in vitro. Horm Metab Res. 2000; 32: 125–128.
- Higuchi T., Villee C.A. Aromatization of epitestosterone by human placenta. Endocrinol. 1970; 86: 912–913.
- Korenman S.G., Wilson H., Lipsett M.B. Isolation of 17α–hydroxyandrost–4–en–3–one (epitestosterone) from human urine. J Biol Chem. 1964; 4(239): 1004—1006.
- De Nicola A.F., Dorfman R.I., Forchielli E. Urinary excretion of epitestosterone and testosterone in normal individuals and hirsute and virilized females. Steroids. 1966; 7: 351–362.
- Järvinen E., Kidron H., Finel M. Human efflux transport of testosterone, epitestosterone and other androgen glucuronides. J Steroid Biochem Mol Biol. 2020;197: 105518.
- Raynaud E., Audran M., Pages J.C., et al. Study of urinary excretion of testosterone and epitestosterone glucuronides in children and adolescents. Pathol Biol. (Paris). 1993; 41(2):159–163.
- Walton M.J., Anderson R.A., Kicman A.T., et al. A diurnal variation in testicular hormone production is maintained following gonadotrophin suppression in normal men. Clin Endocrinol. (Oxf). 2007; 66(1):123–129.
- Abushareeda W., Vonaparti A., Saad K.A., et al. High resolution full scan liquid chromatography mass spectrometry comprehensive screening in sports antidoping urine analysis. J Pharm Biomed Anal. 2018; 151:10–24.
- Moussa F., Mokh S., Doumiati S., et al. LC-MS/MS method for the determination of hormones: Validation, application and health risk assessment in various bovine matrices. Food Chem Toxicol. 2020; 138:111204.
- Wedge A., Hoover M., Pettit-Bacovin T., et al. Development of a Rapid, Targeted LC-IM-MS Method for Anabolic Steroids. J Am Soc Mass Spectrom. 2023; 34(8):1708–1714.
- Dumestre-Toulet V., Cirimele V., Ludes B., et al. Hair analysis of seven bodybuilders for anabolic steroids, ephedrine, and clenbuterol. J Forensic Sci. 2002; 47 (1): 211–214.
- Wood R.I., Stanton S.J. Testosterone and sport: current perspectives. Horm Behav. 2012; 61(1): 147–155.
- Catlin D.H., Cowan D.A., de la Torre R., et al. Urinary testosterone (T) to epitestosterone (E) ratios by GC/MS. I. Initial comparison of uncorrected T/E in six international laboratories. J Mass Spectrom. 1996;31(4):397–402.
- Viljanto M., Hincks P., Hillyer L., et al. Monitoring dehydroepiandrosterone (DHEA) in the urine of Thoroughbred geldings for doping control purposes. Drug Test Anal. 2018;10(10):1518–1527.
- Yesalis C.E. Anabolic steroids in sport and exercise. Human Kinetics; Champaign, IL. 2002. 493 р.
- The 2011 prohibited list. The World Anti-Doping Code International Standard. 2011.
- Okamoto M., Setaishi C., Horiuchi Y., et al. Urinary excretion of testosterone and epitestosterone and plasma levels of LH and testosterone in the Japanese and Ainu. J Clin Endocrinol Metab. 1971;32(5):673–674.
- Park J., Park S., Lho D., et al. Drug testing at the 10th Asian Games and 24th Seoul Olympic Games. J Anal Toxicol. 1990;14: 66–72.
- Coll S., Shiomura S., Alechaga É., et al. Detection of Oral Testosterone Undecanoate Administration in UGT2B117 del/del and del/ins Individuals. Part I: Urinary Steroid Profile and IRMS Markers. Drug Test Anal. 2025;17(8):1394–1404.
- Kicman A.T., Gower D.B. Anabolic steroids in sport: biochemical, clinical and analytical perspectives. Ann Clin Biochem. 2003; 40: 321‒326.
- Goodrum J.M., Moore C., Crouch A.K., et al. Influence of multiple human chorionic gonadotropin administrations on serum and urinary steroid Athlete Biological Passport profiles in males. Drug Test Anal. 2023;15(11–12):1371–1381.
- Albeiroti S., Ahrens B.D., Sobolevskii T., et al. The influence of small doses of ethanol on the urinary testosterone to epitestosterone ratio in men and women. Drug Test Anal. 2018;10(3): 575–583.
- Iannone M., Alberti F., Braganò M.C., et al. Influence of synthetic isoflavones on selected urinary steroid biomarkers: Relevance to doping control. Steroids. 2021; 174: 108900.
- Lundmark J., Gårevik N., Thörngren J.O., et al. Non-steroidal anti-inflammatory drugs do not influence the urinary testosterone/epitestosterone glucuronide ratio. Front Endocrinol (Lausanne). 2013;4 :51.
- Coll S., Hernández D., Bressan C., et al. Impact of Repeated Glucocorticoid Oral Administration on the Urinary Steroid Profile Drug Test Anal. 2025;17(9):1537–1544.
- Tai S.S., Xu B., Welch M.J., et al. Development and evaluation of a candidate reference measurement procedure for the determination of testosterone in human serum using isotope dilution liquid chromatography/tandem mass spectrometry. Anal Bioanal Chem. 2007; 388: 1087—1094.
- Botelho J.C., Shacklady C., Cooper H.C., et al. Isotope-Dilution Liquid Chromatography—Tandem Mass Spectrometry Candidate Reference Method for Total Testosterone in Human Serum. Clin Chem. 2013; 59: 372—380.
- Синдром гипогонадизма у мужчин. Клинические рекомендации Российской ассоциации эндокринологов (РАЭ). М., 2021. 32 с. URL: https://endoinfo.ru/upload/Клинические_рекомендации_ЭНЦ_2021_Синдром_гипогонадизма_у_мужчин.pdf (дата обращения: 03.11.2025).
- Salonia A., Bettocchi C., Capogrosso P., et al. EAU Guidelines on Sexual and Reproductive Health. European Association of Urology (EAU), 2024. 312 р.
- Калинченко С.Ю., Тюзиков И.А. Практическая андрология. Руководство для врачей. М.: Практическая медицина, 2009. 400 с.
- Братчиков О.И., Тюзиков И.А., Греков Е.А. Тестостерон-ресторативная терапия мужского гипогонадизма. Практическое руководство для врачей. М.: ГЭОТАР-Медиа, 2024. 176 с.
- Gelmann E.P. Molecular biology of the androgen receptor. J Сlin Oncol. 2002; 20 (13): 3001—3015.
Сведения об авторах/ Authors’ information
Греков Евгений Александрович – врач уролог–андролог, эндокринолог, главный врач Клиники «Hormone Life», Москва, Россия. Адрес: 123022 Россия, г. Москва, ул. 1905 года, 23. E–mail: gea84@bk.ru; РИНЦ AuthorID: 705263.
Grekov Evgeniy Alexandrovich – urologist-andrologist, endocrinologist, Chief Physician of the «Hormone Life» Clinic, Moscow, Russia
Тюзиков Игорь Адамович – врач уролог–андролог, кандидат медицинских наук, профессор Российской академии естествознания (РАЕ), врач-уролог МЦ «Тандем–Плюс», Ярославль, Россия. Адрес: 150000 Россия, г. Ярославль, Первомайский пер., д. 3-В. E–mail: phoenix-67@list.ru; ORCID 0000-0001-6316-9020; РИНЦ AuthorID: 623245; eLibrary SPIN: 3026–1218.
Tyuzikov Igor Adamovich – urologist–andrologist, PhD, Professor of the Russian Academy of Natural History (RANH), «Tandem-Plus», Yaroslavl, Russia.
Вклад авторов
Е.А. Греков: обзор публикаций по теме статьи, написание статьи.
И.А. Тюзиков: обзор публикаций по теме статьи, сбор и обработка материала для анализа, написание статьи
Authors’ contributions
E.A. Grekov: review of publications on the topic of the article, article writing.
I.A. Tyuzikov: review of publications on the topic of the article, collection and processing of material for analysis, article writing
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. The authors declare no conflict of interest.
Финансирование. Работа выполнена без спонсорской поддержки.
Funding. The work was performed without external funding.

